
El sistema periódico de los elementos es una disposición que representa los elementos químicos. Por lo general, el sistema periódico de elementos se organiza en forma tabular.
La disposición del sistema periódico de los elementos se basa en números atómicos, configuraciones electrónicas y propiedades químicas.
La siguiente es la disposición del sistema periódico de elementos:
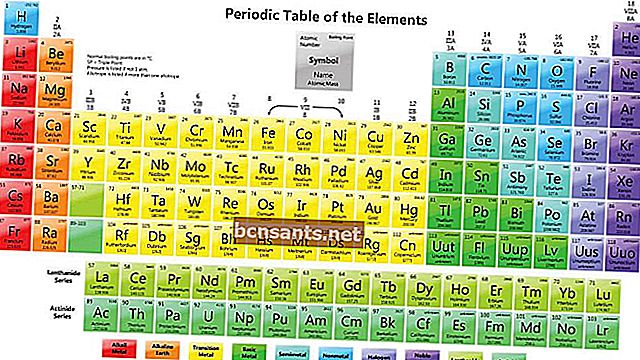
Cómo leer elementos en el sistema periódico de los elementos.
En SPU, encontrará la escritura de cada elemento como se muestra a continuación.
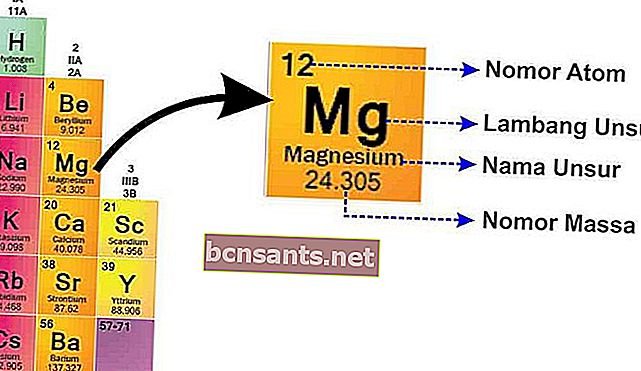
A partir de esta imagen se puede explicar:
- Número de masa
El número de masa es el núcleo del átomo que tiene una carga positiva porque hay protones que están cargados positivamente.y neutrones que son neutrales
- Número atómico
El número atómico te dice el número de protones, porque el átomo es neutro, el número atómico también te dice el número de electrones .
Agrupaciones de elementos
En el sistema periódico de elementos, cada elemento se agrupa en consecuencia
- Grupo
Los grupos están en la columna vertical de la tabla del sistema periódico de elementos. Los elementos que están en el mismo grupo tendrán la misma configuración de electrones de valencia.

- Período
Los períodos son los elementos que están en una fila horizontal en la tabla de elementos del sistema periódico. El período muestra la energía de ionización , el radio atómico, la afinidad electrónica y la electronegatividad.

- Bloquear
Un bloque representa una colección de elementos que tienen la misma subcapa de electrones de valencia.

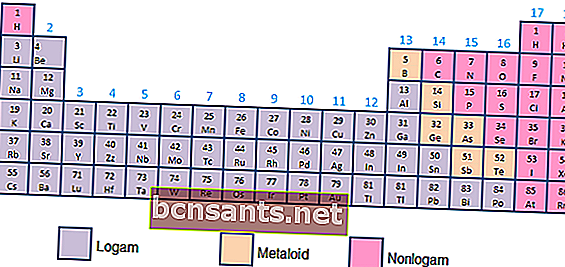
- Metales, metaloides y no metales
Según las propiedades químicas y físicas, los elementos se pueden clasificar en metales (alta conductividad), metaloides (conductividad entre metales y no metales) o no metales (que no tienen propiedades de conductividad, en forma de gases).
Energía de ionización, radio atómico, afinidad electrónica y electronegatividad
La energía de ionización, el radio atómico, la afinidad electrónica y la electronegatividad se pueden ver en función de los períodos y grupos de elementos del sistema elemental.
Lea también: ¿Cómo se identifican los cuerpos de las víctimas de accidentes aéreos?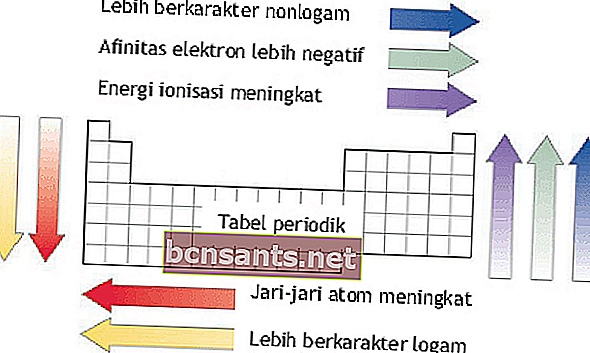
Energía de ionización
La energía de ionización es la energía necesaria para eliminar un electrón externo de un átomo en estado gaseoso.
En un período, la energía de ionización aumenta de izquierda a derecha a medida que aumenta el número atómico.
Dentro de un grupo, las energías de ionización disminuyen de arriba hacia abajo a medida que aumenta el número atómico.
Radio atómico
El radio atómico es la distancia del núcleo atómico a la trayectoria más externa del átomo.
En un período, el radio atómico aumenta de arriba hacia abajo.
Dentro de un grupo, el radio atómico aumenta de derecha a izquierda.
Afinidad electronica
La afinidad electrónica es la energía liberada por un átomo en su estado gaseoso para formar iones negativos.
En un período, la afinidad electrónica aumenta de abajo hacia arriba. Dentro de un grupo, la afinidad electrónica aumenta de izquierda a derecha.
Electronegatividad
La electronegatividad es el valor de la tendencia de un átomo a atraer electrones en la formación de enlaces químicos. Esta propiedad es importante en la formación de enlaces entre átomos.
En un período, la electronegatividad aumenta de abajo hacia arriba.
En un período, la electronegatividad aumenta de izquierda a derecha.
Referencia
- Tabla periodica de los elementos
- //www.studiobelajar.com/sistem-periodic-elements/
